

分享最新资讯



上海,2024年2月29日——洛启生物,一家致力于纳米抗体创新药研发的生物技术公司,公布了抗TSLP纳米抗体(Nb3341)基于毕赤酵母表达系统生产工艺开发及放大的研究进展。相关成果以“High performance production process development and scale-up of an anti-TSLP nanobody”为题在线发表于《Protein Expression and Purification》杂志,万亚坤博士为该论文通讯作者。

纳米抗体(Nanobodies,Nbs)是一类在治疗和诊断等生物技术领域具有巨大潜在应用价值的基因工程抗体。本研究建立了一种抗 TSLP 纳米抗体(Nb3341)在毕赤酵母表达系统中发酵培养和蛋白纯化的方法,并成功将抗 TSLP 纳米抗体(Nb3341)生产规模放大到 100 L。研究通过PB实验、发酵工艺优化和纯化填料筛选,确定小试工艺。经过工艺放大,Nb3341在 100 L规模表达量为 22.97 g/L,原液SEC-HPLC 纯度为 98.7%,AEX-HPLC 纯度为 95.7%,HCP 含量为 4 ppm,HCD 残留量为 1pg/mg。 100 L工艺放大后的实验结果与7 L小试工艺开发的结果一致,进一步证明了该方法的可行性和稳定性。此项研究为纳米抗体从实验室规模到商业生产规模转化提供了高效和稳定的路径,基于毕赤酵母稳定的遗传特性和工艺重现性,为未来实现更大规模的商业化生产提供了坚实的研究基础。
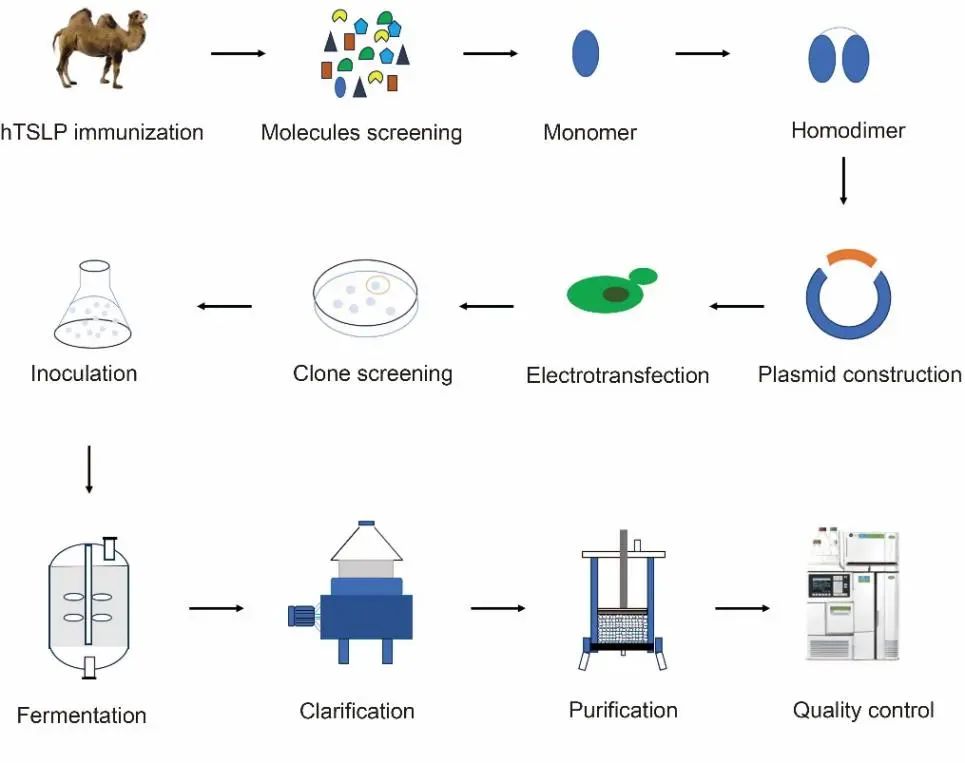
图1 纳米抗体免疫、筛选、表达和纯化流程图
关于TSLP
胸腺基质淋巴细胞生成素 (Thymic stromal lymphopoietin,TSLP) 是一种上皮细胞衍生的细胞因子,在皮肤、呼吸道和胃肠道等部位的屏障表面发生的2型炎症反应调节中起着至关重要的作用。TSLP抗体具有特异性结合人TSLP的能力,可阻断其与受体复合物的相互作用,有效抑制TSLP靶向的免疫细胞释放促炎因子,进而预防哮喘加重,改善哮喘控制。TSLP是各类表型哮喘中的关键介质,靶向TSLP及其信号转导的抗体药物被认为是治疗哮喘的有效策略。目前TSLP靶点临床在研药物多为单克隆抗体,药物剂型为皮下注射液,商业化竞争激烈,差异化吸入产品亟待推出。
关于LQ043H
LQ043H是洛启生物具备完整自主知识产权的抗TSLP纳米抗体药物:
1、LQ043H采用雾化吸入给药使得药物直达肺部病灶区,快速起效,同时避免肝脏首过效应,减少系统性暴露毒性,既兼顾了吸入式给药的优势,又规避了皮下给药的副作用;
2、 LQ043H适用市售便携式雾化器,患者顺应性得到大幅提高;
3、LQ043H利用毕赤酵母生产系统,产量高,极具商业化推广优势;
4、目前,LQ043H的序列、衍生物及用途等已向中国、欧洲、美国等国家/地区申请专利保护,且已获得中国发明专利授权(授权公告号CN114853888B)。
5、 LQ043H哮喘适应症中国临床Ia期研究已经完成,安全性良好,即将进入Ib/II期临床研究。
关于洛启生物毕赤酵母CMC平台
洛启生物已成功建立毕赤酵母CMC平台,目前已具备多个完整项目开发经验。毕赤酵母CMC平台90%以上的项目产量在1g/L以上,纯化平台工艺,其整体回收率在50%以上。从细胞株构建到蛋白纯化仅需3-4个月,极大地缩短了项目开发时间。 洛启生物建立的小试和中试表达平台,包括12台7L发酵罐和2台100 L发酵罐,同时配套了相应的纯化系统;此外,500L毕赤酵母中试GMP洁净厂房已经稳定用于临床样品生产,使得洛启生物具备临床I期、II期样品生产能力。毕赤酵母纳米抗体500L GMP中试生产车间的建成填补了该领域的行业空白,极具稀缺性与竞争性。
关于洛启生物
上海洛启生物医药技术有限公司是一家致力于纳米抗体药物研发及产业化的创新型生物制药企业,公司成立于2017年10月,位于上海国际医学园区,已建立完善的研发、CMC及中试生产平台及体系,是国内目前唯一具备纳米抗体全流程开发能力的公司。洛启生物搭建了500 L毕赤酵母纳米抗体GMP中试生产车间,填补了该领域的行业空白,极具稀缺性与竞争性。 截止2024年1月,申请国内外发明专利80余项,获得授权28项。洛启生物已经开发了数十种纳米抗体药物,管线涵盖呼吸系统、自免、眼科和肿瘤等领域,目前已获得4个临床批件。洛启生物在研产品LQ036及LQ043H颠覆了现有呼吸类疾病的治疗方式,均为同靶点的全球首创吸入式纳米抗体药物。LQ036哮喘适应症已在中国和澳洲(已完成)开展临床 I 期试验,人体试验表现出优异的安全性及耐受性,目前已经进入临床II期研究;LQ036 COPD 适应症临床已于2023年9月获得CDE批准。LQ043H哮喘适应症中国临床Ia期研究已经完成,安全性良好,即将进入Ib/II期临床研究。LQ043H 是对 LQ036 患者群体的补充,两个项目覆盖了全部中重度哮喘人群。